研究テーマ
Research
1)統合失調症や発達障害の原因究明
発達性精神疾患,なかでも統合失調症,注意欠陥多動性障害(ADHD)や自閉症は人口の約0.3~1%が罹患する重大な疾患ですが、その原因はほとんど判っていません。糖尿病や高血圧と同様に生育環境と遺伝が関与すると考えられており,環境因子としては母体のウイルス感染や周産障害,出産時虚血,幼児ストレスなどが要因として挙げられています.それらの環境因子に共通する分子要因として,サイトカインの関与が疑われていました.サイトカインの多くは神経栄養因子としても作用しますが,私達がサイトカインの新生仔投与やそのトランスジェニックマウスを用いて検討したところ,末梢性に投与・誘導されたサイトカインは脳血液関門を通過し,脳発達を障害して認知行動障害を誘発していることが判明しました.そこで私達は,この「脳発達の障害」の実態を細胞・分子レベルで特定し,そのメカニズムを明らかにしたいと考えています.
統合失調症の母体・新生児炎症仮説
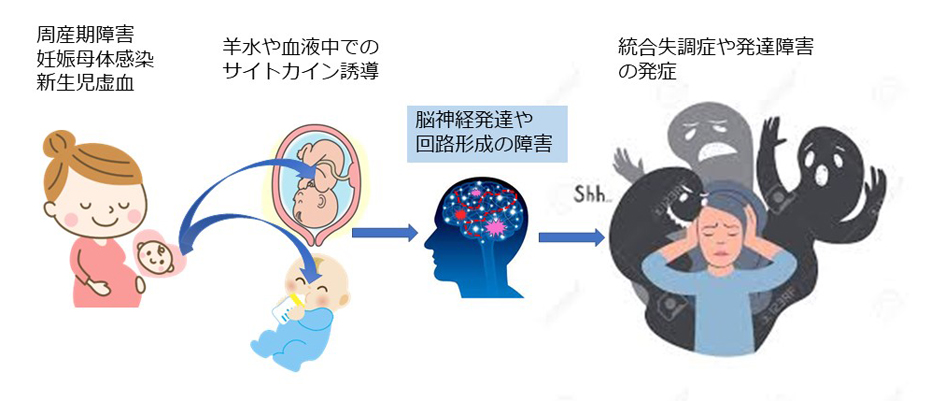
1-1.精神疾患の動物モデルの作製と解析
炎症は生体防御における統合的システムであり,多種多様な細胞がサイトカインと呼ばれる分子群をやり取りして協調的,かつ系統的に駆動することで,生体防御に貢献します.たとえば,皮膚損傷がおきると,血液凝固とともに血小板から放出されたロイコトリエンやケモカインが白血球を呼び寄せて「腫脹」を起こし,そこから放出されたインターロイキン類は血管透過性を増強して「発赤」を起こし,血小板中に含まれていた細胞増殖性サイトカインが組織の修復を促します.細菌やウイルスの感染でも同様に多くのサイトカインが誘導されます.しかし,脳が未発達な胎児期や新生児期にサイトカインが誘導されてしまうと,正常な脳発達を障害することが知られています.特に私達は,上皮成長因子(EGF)と呼ばれるサイトカインを動物に投与することで,認知行動異常を呈する動物モデルを作製し,分子生物学,神経生理学,神経薬理学を駆使してその認知行動異常の病態と原因を究明しています.
ラット陰性発声で誘発される錯乱様回避行動

代表論文
- Mol Psychiatry. 2000; 5(6): 594-603. PMID: 11126390
- Psychiatry Clin Neurosci. 2010; 64(3): 217-30. PMID: 20602722
1-2.統合失調症動物モデルの聴覚異常(幻聴)機序の解明
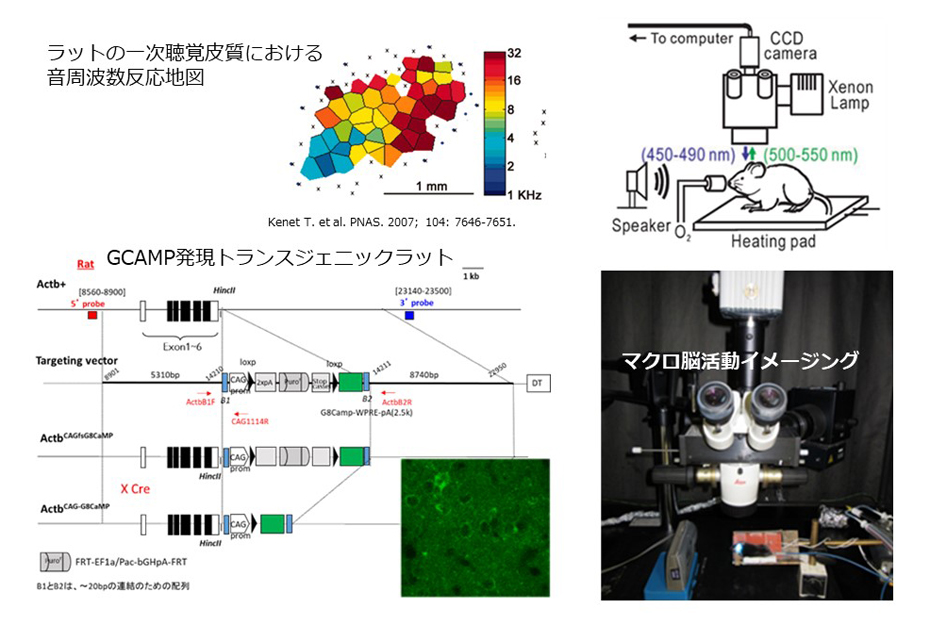
上皮成長因子(EGF)を投与されたラットは,音声弁別能力が低く,独語を発する傾向にあり,音誘発性の錯乱を呈することがあります.脳波を測定しても,患者類似の障害を呈することや,聴覚皮質が環境音とは無関係に過活動しているなど,幻聴に類似の現象が引き起こされている可能性が示唆されました.そこで,当該モデル動物の脳活動をマクロ蛍光顕微鏡や内視鏡型蛍光顕微鏡を用いて観察し,各種音や無音に対してどのような聴覚系神経活動パターンを示すかを分析することで,実際に動物にとって意味のある聴覚系神経活動であるかの判定を試みています.
GCAMPイメージングによる幻聴脳活動の可視化
代表論文
- Sci Rep. 2022; 12(1): 12917. PMID: 35902695
- Neurosci Res. 2022; 175: 62-72. PMID: 34699860
1-3.ドパミン神経活動による認知機能および恐怖情動の制御メカニズムの分析
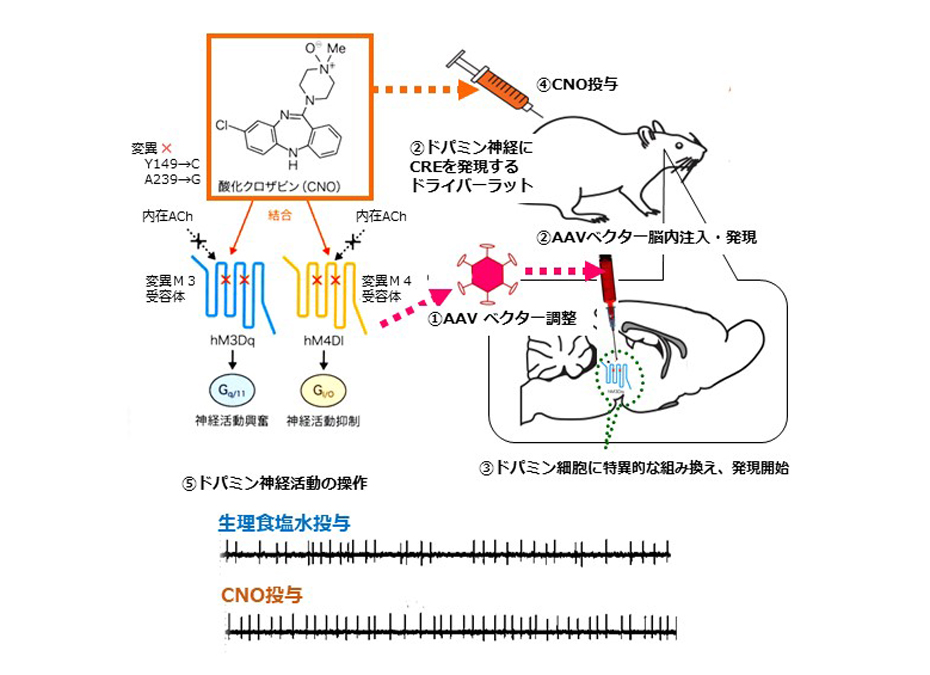
ドパミンは覚醒剤の作用でも知られるように,ヒトの認知機能や恐怖情動に大きな影響を与えています.そのため,ドパミン神経のどのような活動がどうやってこれらの脳機能を調節しているのか?を解き明かすことは重要な意味があります.具体的には,中脳のドパミン神経細胞の一部に人工薬物感受性チャネルもしくは光依存性ロドプシンチャネルを人為的に強制発現させ,薬理学的,光遺伝学的手法を使って,ドパミンの神経活動を外部から任意に操作します.このように一部のドパミン神経活動を介入操作することで,どの脳部位でドパミン放出が認知機能や恐怖情動を調節しているのかを探求しています.
酸化クロザピンによる人為的神経活動操作
代表論文
- FASEB J. 2022; 36(2): e22160.PMID: 35064699
- Neuroscience. 2020; 441: 22-32.PMID: 32531471
2)侵害受容性体性感覚(痛み・痒み)調節機構の解明
痛みや痒みといった侵害受容性体性感覚は,私達の身体に生じた異常を知るための警告系として重要な役割を果たしていますが,それらが過剰で持続的になると耐え難い苦痛をもたらします.実際に,難治性の痛みや痒みは人口の約20%に影響を及ぼすと言われ,生活の質を低下させる要因になっていますが,そのような病態には未だ有効な治療法が確立されていません.私達は,病的な痛みや痒みが引き起こされる仕組みを細胞・分子レベルで明らかにするとともに,様々な薬物の影響を評価することで,新しい治療薬の開発に繋げるための研究を行っています.
体性感覚異常の克服を目指した研究

2-1.神経炎症に着目した慢性疼痛の病態解明
神経の損傷や糖尿病などの疾患による慢性的な痛みには,従来の鎮痛薬が奏功しないため,従来とは異なる治療戦略の確立が求められています.私達はこれまでに,慢性疼痛モデル動物の末梢神経系に浸潤する免疫細胞や,感覚情報が入力する脊髄で活性化されるグリア細胞の役割を検討しています.特に末梢マクロファージや脊髄ミクログリアが産生する炎症性サイトカイン・ケモカインの病態生理学的意義を明らかにしてきました.最近では,このような痛みの病態メカニズムにおける性差にも着目しており,種々の遺伝子改変動物を用いた遺伝子発現解析,組織化学解析,行動薬理学解析などの手法を通じて,慢性疼痛の病態解明を目指した研究を行っています。
痛みの増悪に関わるマクロファージ・ミクログリアの性差

代表論文
- J Neuroinflammation. 2018; 15(1): 96. PMID: 29587798
- Cells. 2021; 10(4): 874. PMID: 33921365
- Glia. 2024. PMID: 38591338
2-2.難治性の痒みを担う神経メカニズムの解明
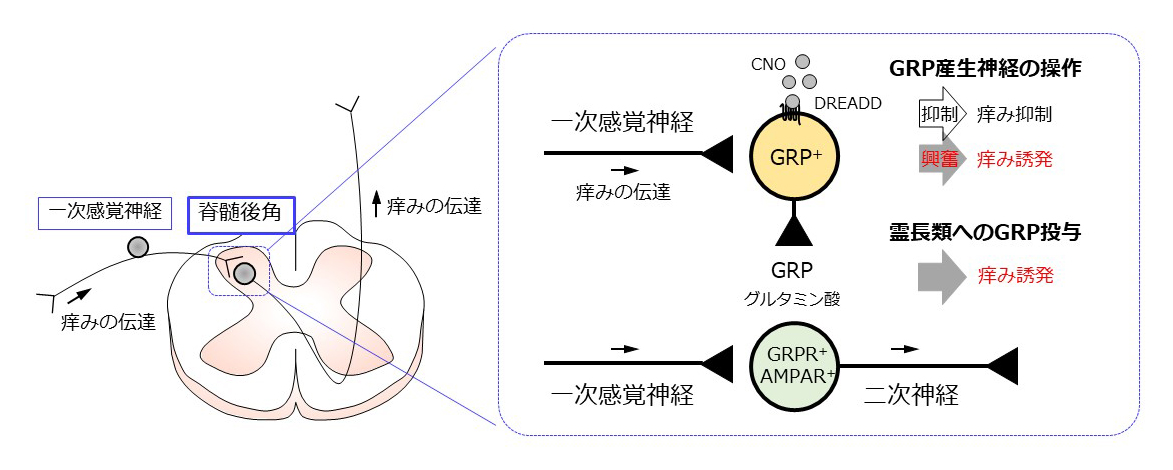
痒みと痛みは異なる感覚であることが示されていますが,詳細な痒みの伝達機構は未だ明らかにされていません。私達はこれまでに,一次感覚神経から脊髄へと伝達される痒み情報の調節に関わるガストリン放出ペプチド(GRP)の役割を検討し,げっ歯類や非ヒト霊長類の脊髄においてGRP受容体(GRPR)を発現する痒み応答神経が痒み伝達に不可欠であることを証明してきました.次の段階として,アトピー性皮膚炎や接触皮膚炎などに付随する難治性の痒みに対し,GRP-GRPRシステムがどのように関わるのかを明らかにするため,種々の遺伝子改変動物や非ヒト霊長類を用いた遺伝子発現解析,電気生理学解析,行動薬理学解析を展開しています。
痒みの伝達を担うGRP-GRPRシステム
代表論文
- Neuropharmacology. 2020; 170: 108025. PMID: 32142790
- Biochem Pharmacol. 2022; 198: 114972. PMID: 35189108
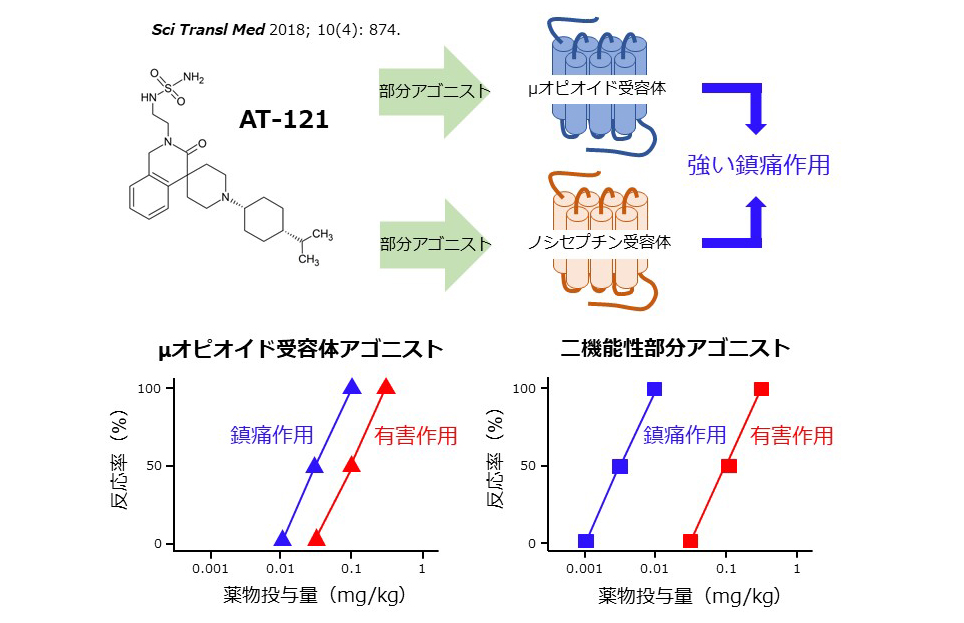
2-3.安全な新規オピオイド化合物の薬効評価
モルヒネなどの鎮痛薬は疼痛緩和に不可欠ですが、痒みや呼吸抑制といった急性の有害作用,また薬物依存という長期の有害作用が問題となる場合があります.私達はこれまでに,モルヒネが作用するμオピオイド(MOP)受容体と同じファミリーに属する,ノシセプチン(NOP)受容体が非ヒト霊長類において強力な鎮痛作用をもたらすことを報告してきました.そこで,MOPおよびNOP受容体の両者に部分アゴニストとして作用する新しい鎮痛化合物の薬効評価を行ったところ,それらはモルヒネに匹敵する鎮痛作用を有しながらも,痒みや呼吸抑制,薬物依存などの有害作用をいずれも生じないことを発見し,創薬に向けて現在はさらに詳細な解析に取り組んでいます.
安全な新規鎮痛化合物:二機能性部分アゴニスト
代表論文
- Sci Transl Med. 2018; 10(456): eaar3483. PMID: 30158150
- Br J Anaesth. 2019; 122(6): e146-e156. PMID: 30916003
- Drugs. 2023; 83(9): 771-793. PMID: 37209211